על מנת לערוך סיכומים נדרש לפתוח חשבון.
מבנה האטום: הבדלים בין גרסאות בדף
Ran.Rutenberg (שיחה | תרומות) אין תקציר עריכה |
Ran.Rutenberg (שיחה | תרומות) אין תקציר עריכה |
||
| שורה 32: | שורה 32: | ||
==זיקה אלקטרונית== | ==זיקה אלקטרונית== | ||
==הערכות אלקטרונים ברמות אנרגיה== | |||
===הקדמה=== | |||
לכל יסוד יש מספר אלקטרונים השווה למספר הפרוטונים בגרעינו. | |||
האלקטרונים הם הנותנים את הנפח לאטום. | |||
האלקטרונים אינם סובבים את הגרעין כפי שכוכבי הלכת סובבים את השמש (כלומר פחות או יותר במישור אחד) אלא האלקטרונים סובבים את הגרעין בתוך ענני אלקטרונים. | |||
כל ענן מייצג רמת אנרגיה. | |||
לכל רמת אנרגיה יש מספר מוגבל של אלקטרונים אותם היא יכולה להכיל וכתוצאה מכך לכל היסודות (מלבד מימן (H), והליום (He) יש יותר מרמת אנרגיה אחת. | |||
חלק זה של הסיכום זה יעסוק ברמות אנרגיה אלה ובסידור האלקטרונים בהם. | |||
===רמות האנרגיה=== | |||
רמות האנרגיה של האטום נקראות גם אורביטלים. | |||
ליסודות הטבלה המחזורית יש בין רמת אנרגיה אחת (ליסודות השורה הראשונה) עד לשבע רמות אנרגיה (ליסודות השורה ה- 7). | |||
ככל שרמת האנרגיה גדולה יותר אלקטרוניה רחוקים יותר מהגרעין. | |||
ככל שרמת האנרגיה גבוהה יותר אז יש בה יותר מקום והיא יכולה להכיל יותר אלקטרונים: | |||
*רמת האנרגיה ה- I מכילה עד 2 אלקטרונים. | |||
*רמת האנרגיה ה- II מכילה עד 8 אלקטרונים. | |||
*רמת האנרגיה ה- III מכילה עד 18 אלקטרונים. | |||
*רמת האנרגיה ה- IV מכילה עד 32 אלקטרונים. | |||
*לצורך לימודי הכימיה בתיכון אין צורך לדעת את המקסימום של רמות 5-7. | |||
====כיצד נסדר את האלקטרונים של אטום לפי רמות האנרגיה שלהם?==== | |||
# ראשית כל אנו צריכים לדעת כמה אלקטרונים יש לאטום. אם האטום הוא נייטרלי מבחינה חשמלית (כלומר הוא לא יון, בצורה בה הוא מופיע בטבלה המחזורית), אז מספר האלקטרונים שלו שווה למספר הפרוטונים. למשל נתרן (Na) הוא בעל מספר אטומי 11 (ראה [http://en.wikipedia.org/wiki/Periodic_table_%28huge%29 טבלה מחזורית]) - כלומר יש לו 11 פרוטונים ולפיכך גם 11 אלקטרונים. | |||
# שנית, צריך לדעת כמה רמות אנרגיה יש לאטום בו אנו מעוניינים. מספר רמות האנרגיה שווה למספר המחזור (מספר השורה). נתרן ממוקם במחזור השלישי ולפיכך יש לו 3 רמות אנרגיה. | |||
# שלישית, ניתן לדעת כמה אלקטרונים נמצאים ברמת האנרגיה האחרונה לפי מספר הטור. מספר האלקטרונים ברמה החיצונית שווה למספר הטור. כל לגזים האצילים (טור 8) יש 8 אלקטרונים ברמה החיצונית, למתכות האלקליות עפרוריות (טור 2) יש 2 אלקטרונים ברמה החיצונית וכו'. ההליום הוא יוצא דופן- למרות שהוא ממוקם בטור 8 הוא מכיל 2 אלקטרונים בלבד. יש לשים לב לכך ששיטה זו אינה מתאימה למתכות המעבר. אם נחזור לדוגמה, נתרן ממוקם בטור הראשון יחד עם שאר המתכות האלקליות ולכן יש לו אלקטרון אחד ברמה החיצונית. | |||
# כעת ניתן להתחיל למקם את האלקטרונים החל מהרמה הנמוכה ביותר עד לזו לפני האחרונה. בדוגמה שלנו לנתרן יהיו 2 אלקטרונים ברמה התחתונה. נותרה רמת אנרגיה אחת (הרמה ה- II), ונותרו לנו 8 אלקטרונים לשבץ בה. | |||
'''דוגמא נוספת'''<BR> | |||
ברצוננו לסדר את האלקטורנים של האטום אסטטין (At).<BR> | |||
'''פתרון'''<BR> | |||
ראשית כל נבדוק כמה אלקטורונים יש לאסטטין. לאסטטין יש מספר אטומי 85, כיוון שלא מדובר ביון אלא באטום נייטרלי אז יש לו 85 אלקטרונים גם כן.<BR> | |||
שנית, אסטטין ממוקם במחזור ה-6 כלומר יש לו שש רמות אנרגיה שונות. בנוסף לכך הוא ממוקם בטור השביעי כלומר יש לו 7 אלקטרונים ברמה האחרונה. | |||
כעת ניתן להתחיל לסדר את האלקטרונים. ברמה הראשונה נסדר את מקסימום האלקטרונים - 2. כיוון שכפי שניתן לראות עדייםן לא שיבצנו את כל האלקטרונים נמשיך ונשבץ את המקסימום ברמות השנייה (8), השלישית (18) והרביעית (32).<BR> | |||
כעת שיבצנו כבר 67 אלקטרונים מתוך 85 אותם יש לשבץ - כלומר נותרו 18 אלקטרונים ובמקביל נותרה רק הרמה החמישית. נשבץ את האלקטרונים הנותרים ברמה החמישית. ניתן לבדוק ולראות שסכום כל האלקטרונים ששיבצנו הוא 85, יש 6 רמות אנרגיה בהתאם למיקום במחזור השישי, יש 7 אלקטרונים ברמה האחרונה המתאימים לטור השביעי ובשום רמה לא עברנו את הערך המקסימלי המותר. | |||
גרסה מ־21:59, 6 במאי 2006
חזרה לכימיה
אי רציפות החומר
חלקיקים תת אטומיים
כל אטום מורכב מגרעין ומענן אלקטרונים. הגרעין, הנמצא במרכז האטום ומהווה חלק קטן ביותר ממנו (נסו לדמיין כדוררגל המונח באמצע המגרש - הכדור זה בגרעין ומהגרש זהו ענן האלקטרונים). הגרעין מטענו חיובי. הגרעין מכיל על פי רוב שני סוגי חלקיקים - פרוטונים טעונים במטען חיובי, וניוטרונים חסרי המטען (יוצא דופן הוא אטום המימן המכיל פרוטון אחד בלבד ואינו מכיל ניוטרונים). את ענן האלקטרונים מרכיבים כצפוי אלקטרונים טעונים שלילית. צורת הענן משתנה בהתאם לרמת האנרגיה שלו (אין צורך לדעת את צורות העננים - זהו חומר מתקדם בהרבה מזה של הבגרות).
מספר אטומי
יסודות הטבלה המחזורית מסודרים כידוע לפי מספר אטומי. המספר האטומי אינו אלא מספר הפרוטונים הנמצאים בגרעין - פשוט עד כדי כך. לכל יסוד יש מספר אטומי המתאים רק לו. לדוגמא למימן יהיה תמיד מספר אטומי 1 - יש לו פרוטון אחד בגרעין. לחמצן מספר אטומי 8 - יש לו 8 פרוטונים בגרעין וכו'.
מספר מסה
מספר מסה הוא מספר החלקיקים, פרוטונים וניוטרונים, הנמצאים בגרעין. ליסוד הליום He יש שני פרוטונים ושני ניוטרונים ולכן מספר המסה שלו הוא 4. לסידן Ca יש 20 פרוטונים ו- 20 ניוטרונים ולכן יש לו מספר מסה 40. טעות נפוצה אצל תלמידים רבים היא לחשוב שמספר המסה הוא תמיד פי 2 מהמספר האטומי - זוהי שגיאה חמורה! ויש לשים לב שלא ליפול בה. ברב האטומים,בייחוד באלו בעלי מספר אטומי גבוה, אין כך הדבר - בברזל Fe יש 26 פרוטונים ו- 30 ניוטרונים ולכן מספר המסה שלו הוא 56 (ולא 52 כפי שחלק יטו לחשוב), דוגמא נוספר היא האטום זהב Au - לאטום זה 79 פרוטונים ו- 118 ניוטרונים ולכן בעל מספר מסה 197 (ולא 158).
איזוטופים
כפי שאנו יודעים כל יסוד מאופיין ע"פ המספר האטומי שלו, כלומר מספר הפרוטונים בגרעין. המספר האטומי הוא המעניק את לאטום את הזהות של יסוד מסויים, ולפיו אנו מסוגלים להבדיל בין יסוד אחד למשנהו. לפיכך אטום בעל 6 פרוטונים ו- 6 ניוטרונים הוא אטום פחמן כפי שאטום בעל 6 פרוטונים ו-8 ניוטרונים הוא אטום פחמן. כיוון שהטבלה המחזורית מסודרת לפי מספר אטומי עולה נוכל בנקל לראות שאת שני אטומי הפחמן שהצגנו נמקם באותו מקום.
עולה השאלה אם כך מה ההבדל בין שני אטומי הפחמן שהוזכרו? ההבדל הבולט ביותר הוא במסה - לראשון יש מספר מסה 12 (6+6=12) ואילו לשני יש מספר מסה 14 (6+8=14). אטומים בעלי אותו מספר אטומי, בעלי תכונות כימיות זהות ונימצאים באותו מקום בטבלה המחזורית נקראים איזוטופים. כדי להבדיל בין האיזוטופים השונים של אטום מסויים מקובל לרשום את סמל האטום כשמשמאלו למעלה רשום מספר המסה ומשמאל למטה רשום מספר האטומי: לדוגמא ניתן לראות את הסימון השונה לפחמן בעל מסה 12 ופחמן בעל מסה 14: ![]() .
.
ראיות לקיום הגרעין
איזוטופים
כפי שאנו יודעים כל יסוד מאופיין ע"פ המספר האטומי שלו, כלומר מספר הפרוטונים בגרעין. המספר האטומי הוא המעניק את לאטום את הזהות של יסוד מסויים, ולפיו אנו מסוגלים להבדיל בין יסוד אחד למשנהו. לפיכך אטום בעל 6 פרוטונים ו- 6 ניוטרונים הוא אטום פחמן כפי שאטום בעל 6 פרוטונים ו-8 ניוטרונים הוא אטום פחמן. כיוון שהטבלה המחזורית מסודרת לפי מספר אטומי עולה נוכל בנקל לראות שאת שני אטומי הפחמן שהצגנו נמקם באותו מקום.
עולה השאלה אם כך מה ההבדל בין שני אטומי הפחמן שהוזכרו? ההבדל הבולט ביותר הוא במסה - לראשון יש מספר מסה 12 (6+6=12) ואילו לשני יש מספר מסה 14 (6+8=14). אטומים בעלי אותו מספר אטומי, בעלי תכונות כימיות זהות ונימצאים באותו מקום בטבלה המחזורית נקראים איזוטופים. כדי להבדיל בין האיזוטופים השונים של אטום מסויים מקובל לרשום את סמל האטום כשמשמאלו למעלה רשום מספר המסה ומשמאל למטה רשום מספר האטומי: לדוגמא ניתן לראות את הסימון השונה לפחמן בעל מסה 12 ופחמן בעל מסה 14: ![]() .
.
רדיואקטיביות
בטבלה המחזורית יש מספר של יסודות להם יש איזוטופים רדיואקטביים. משמעות הדבר שהם פולטים ממגרעינם חלקיקים ו/או אנרגיה באופן ספונטני. יש שלושה סוגים של קרינה רדיו אקטיבית:
- קרינת α (אלפא): קרינה בה נפלט גרעין של הליום מתוך גרעין האטום - כלומר נפלטים שני פרוטונים ושני ניוטרונים. לדוגמא
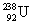 הופך אחרי פליטת קרינת α ל-
הופך אחרי פליטת קרינת α ל- 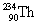 . הדבר מתבטא בירידה של 2 במספר האטומי וירידה של 4 במספר מסה.
. הדבר מתבטא בירידה של 2 במספר האטומי וירידה של 4 במספר מסה. - קרינת β (בטא): קרינה במהלכה נפלט אלקטרון 'מתוך הגרעין', המספר האטומי עולה באחד אך המסה נשארת. תיאוריה מקובלת המסבירה את פליטתו של אלקטרון מתוך הגרעין גורסת שניוטרון אחד מתפצל לאלקטרון שמשתחרר ולפרוטון שנשאר בגרעין. לדוגמא
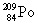 הופך לאחר שנפלטה ממנו קרינה β ל-
הופך לאחר שנפלטה ממנו קרינה β ל- 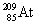 .
. - קרינת γ (גמא): קרינה המורכבת מאנרגיה בלבד -ללא חומר. אין היא משנה את תכונות האטום. האנרגיה הנפלטת היא בצורת גלים אלקטרומגנטים בעלי אורך הגל הקצר ביותר ולכן גם זוהי הקרינה האלקטרומגנטית החזקה ביותר.
אנרגיית יינון
זיקה אלקטרונית
הערכות אלקטרונים ברמות אנרגיה
הקדמה
לכל יסוד יש מספר אלקטרונים השווה למספר הפרוטונים בגרעינו. האלקטרונים הם הנותנים את הנפח לאטום. האלקטרונים אינם סובבים את הגרעין כפי שכוכבי הלכת סובבים את השמש (כלומר פחות או יותר במישור אחד) אלא האלקטרונים סובבים את הגרעין בתוך ענני אלקטרונים. כל ענן מייצג רמת אנרגיה. לכל רמת אנרגיה יש מספר מוגבל של אלקטרונים אותם היא יכולה להכיל וכתוצאה מכך לכל היסודות (מלבד מימן (H), והליום (He) יש יותר מרמת אנרגיה אחת. חלק זה של הסיכום זה יעסוק ברמות אנרגיה אלה ובסידור האלקטרונים בהם.
רמות האנרגיה
רמות האנרגיה של האטום נקראות גם אורביטלים. ליסודות הטבלה המחזורית יש בין רמת אנרגיה אחת (ליסודות השורה הראשונה) עד לשבע רמות אנרגיה (ליסודות השורה ה- 7). ככל שרמת האנרגיה גדולה יותר אלקטרוניה רחוקים יותר מהגרעין. ככל שרמת האנרגיה גבוהה יותר אז יש בה יותר מקום והיא יכולה להכיל יותר אלקטרונים:
- רמת האנרגיה ה- I מכילה עד 2 אלקטרונים.
- רמת האנרגיה ה- II מכילה עד 8 אלקטרונים.
- רמת האנרגיה ה- III מכילה עד 18 אלקטרונים.
- רמת האנרגיה ה- IV מכילה עד 32 אלקטרונים.
- לצורך לימודי הכימיה בתיכון אין צורך לדעת את המקסימום של רמות 5-7.
כיצד נסדר את האלקטרונים של אטום לפי רמות האנרגיה שלהם?
- ראשית כל אנו צריכים לדעת כמה אלקטרונים יש לאטום. אם האטום הוא נייטרלי מבחינה חשמלית (כלומר הוא לא יון, בצורה בה הוא מופיע בטבלה המחזורית), אז מספר האלקטרונים שלו שווה למספר הפרוטונים. למשל נתרן (Na) הוא בעל מספר אטומי 11 (ראה טבלה מחזורית) - כלומר יש לו 11 פרוטונים ולפיכך גם 11 אלקטרונים.
- שנית, צריך לדעת כמה רמות אנרגיה יש לאטום בו אנו מעוניינים. מספר רמות האנרגיה שווה למספר המחזור (מספר השורה). נתרן ממוקם במחזור השלישי ולפיכך יש לו 3 רמות אנרגיה.
- שלישית, ניתן לדעת כמה אלקטרונים נמצאים ברמת האנרגיה האחרונה לפי מספר הטור. מספר האלקטרונים ברמה החיצונית שווה למספר הטור. כל לגזים האצילים (טור 8) יש 8 אלקטרונים ברמה החיצונית, למתכות האלקליות עפרוריות (טור 2) יש 2 אלקטרונים ברמה החיצונית וכו'. ההליום הוא יוצא דופן- למרות שהוא ממוקם בטור 8 הוא מכיל 2 אלקטרונים בלבד. יש לשים לב לכך ששיטה זו אינה מתאימה למתכות המעבר. אם נחזור לדוגמה, נתרן ממוקם בטור הראשון יחד עם שאר המתכות האלקליות ולכן יש לו אלקטרון אחד ברמה החיצונית.
- כעת ניתן להתחיל למקם את האלקטרונים החל מהרמה הנמוכה ביותר עד לזו לפני האחרונה. בדוגמה שלנו לנתרן יהיו 2 אלקטרונים ברמה התחתונה. נותרה רמת אנרגיה אחת (הרמה ה- II), ונותרו לנו 8 אלקטרונים לשבץ בה.
דוגמא נוספת
ברצוננו לסדר את האלקטורנים של האטום אסטטין (At).
פתרון
ראשית כל נבדוק כמה אלקטורונים יש לאסטטין. לאסטטין יש מספר אטומי 85, כיוון שלא מדובר ביון אלא באטום נייטרלי אז יש לו 85 אלקטרונים גם כן.
שנית, אסטטין ממוקם במחזור ה-6 כלומר יש לו שש רמות אנרגיה שונות. בנוסף לכך הוא ממוקם בטור השביעי כלומר יש לו 7 אלקטרונים ברמה האחרונה.
כעת ניתן להתחיל לסדר את האלקטרונים. ברמה הראשונה נסדר את מקסימום האלקטרונים - 2. כיוון שכפי שניתן לראות עדייםן לא שיבצנו את כל האלקטרונים נמשיך ונשבץ את המקסימום ברמות השנייה (8), השלישית (18) והרביעית (32).
כעת שיבצנו כבר 67 אלקטרונים מתוך 85 אותם יש לשבץ - כלומר נותרו 18 אלקטרונים ובמקביל נותרה רק הרמה החמישית. נשבץ את האלקטרונים הנותרים ברמה החמישית. ניתן לבדוק ולראות שסכום כל האלקטרונים ששיבצנו הוא 85, יש 6 רמות אנרגיה בהתאם למיקום במחזור השישי, יש 7 אלקטרונים ברמה האחרונה המתאימים לטור השביעי ובשום רמה לא עברנו את הערך המקסימלי המותר.