על מנת לערוך סיכומים נדרש לפתוח חשבון.
מבנה האטום: הבדלים בין גרסאות בדף
Ran.Rutenberg (שיחה | תרומות) |
Ran.Rutenberg (שיחה | תרומות) אין תקציר עריכה |
||
| שורה 28: | שורה 28: | ||
# '''קרינת β''' (בטא): קרינה במהלכה נפלט אלקטרון ''''מתוך הגרעין'''', המספר האטומי עולה באחד אך המסה נשארת. תיאוריה מקובלת המסבירה את פליטתו של אלקטרון מתוך הגרעין גורסת שניוטרון אחד מתפצל לאלקטרון שמשתחרר ולפרוטון שנשאר בגרעין. לדוגמא [[image:Polonium.gif]] הופך לאחר שנפלטה ממנו קרינה β ל- [[image:Astatine.gif]]. | # '''קרינת β''' (בטא): קרינה במהלכה נפלט אלקטרון ''''מתוך הגרעין'''', המספר האטומי עולה באחד אך המסה נשארת. תיאוריה מקובלת המסבירה את פליטתו של אלקטרון מתוך הגרעין גורסת שניוטרון אחד מתפצל לאלקטרון שמשתחרר ולפרוטון שנשאר בגרעין. לדוגמא [[image:Polonium.gif]] הופך לאחר שנפלטה ממנו קרינה β ל- [[image:Astatine.gif]]. | ||
# '''קרינת γ''' (גמא): קרינה המורכבת מאנרגיה בלבד -ללא חומר. אין היא משנה את תכונות האטום. האנרגיה הנפלטת היא בצורת גלים אלקטרומגנטים בעלי אורך הגל הקצר ביותר ולכן גם זוהי הקרינה האלקטרומגנטית החזקה ביותר. | # '''קרינת γ''' (גמא): קרינה המורכבת מאנרגיה בלבד -ללא חומר. אין היא משנה את תכונות האטום. האנרגיה הנפלטת היא בצורת גלים אלקטרומגנטים בעלי אורך הגל הקצר ביותר ולכן גם זוהי הקרינה האלקטרומגנטית החזקה ביותר. | ||
==אנרגיית יינון== | |||
==זיקה אלקטרונית== | |||
גרסה מ־22:56, 6 במאי 2006
חזרה לכימיה
אי רציפות החומר
חלקיקים תת אטומיים
כל אטום מורכב מגרעין ומענן אלקטרונים. הגרעין, הנמצא במרכז האטום ומהווה חלק קטן ביותר ממנו (נסו לדמיין כדוררגל המונח באמצע המגרש - הכדור זה בגרעין ומהגרש זהו ענן האלקטרונים). הגרעין מטענו חיובי. הגרעין מכיל על פי רוב שני סוגי חלקיקים - פרוטונים טעונים במטען חיובי, וניוטרונים חסרי המטען (יוצא דופן הוא אטום המימן המכיל פרוטון אחד בלבד ואינו מכיל ניוטרונים). את ענן האלקטרונים מרכיבים כצפוי אלקטרונים טעונים שלילית. צורת הענן משתנה בהתאם לרמת האנרגיה שלו (אין צורך לדעת את צורות העננים - זהו חומר מתקדם בהרבה מזה של הבגרות).
מספר אטומי
יסודות הטבלה המחזורית מסודרים כידוע לפי מספר אטומי. המספר האטומי אינו אלא מספר הפרוטונים הנמצאים בגרעין - פשוט עד כדי כך. לכל יסוד יש מספר אטומי המתאים רק לו. לדוגמא למימן יהיה תמיד מספר אטומי 1 - יש לו פרוטון אחד בגרעין. לחמצן מספר אטומי 8 - יש לו 8 פרוטונים בגרעין וכו'.
מספר מסה
מספר מסה הוא מספר החלקיקים, פרוטונים וניוטרונים, הנמצאים בגרעין. ליסוד הליום He יש שני פרוטונים ושני ניוטרונים ולכן מספר המסה שלו הוא 4. לסידן Ca יש 20 פרוטונים ו- 20 ניוטרונים ולכן יש לו מספר מסה 40. טעות נפוצה אצל תלמידים רבים היא לחשוב שמספר המסה הוא תמיד פי 2 מהמספר האטומי - זוהי שגיאה חמורה! ויש לשים לב שלא ליפול בה. ברב האטומים,בייחוד באלו בעלי מספר אטומי גבוה, אין כך הדבר - בברזל Fe יש 26 פרוטונים ו- 30 ניוטרונים ולכן מספר המסה שלו הוא 56 (ולא 52 כפי שחלק יטו לחשוב), דוגמא נוספר היא האטום זהב Au - לאטום זה 79 פרוטונים ו- 118 ניוטרונים ולכן בעל מספר מסה 197 (ולא 158).
איזוטופים
כפי שאנו יודעים כל יסוד מאופיין ע"פ המספר האטומי שלו, כלומר מספר הפרוטונים בגרעין. המספר האטומי הוא המעניק את לאטום את הזהות של יסוד מסויים, ולפיו אנו מסוגלים להבדיל בין יסוד אחד למשנהו. לפיכך אטום בעל 6 פרוטונים ו- 6 ניוטרונים הוא אטום פחמן כפי שאטום בעל 6 פרוטונים ו-8 ניוטרונים הוא אטום פחמן. כיוון שהטבלה המחזורית מסודרת לפי מספר אטומי עולה נוכל בנקל לראות שאת שני אטומי הפחמן שהצגנו נמקם באותו מקום.
עולה השאלה אם כך מה ההבדל בין שני אטומי הפחמן שהוזכרו? ההבדל הבולט ביותר הוא במסה - לראשון יש מספר מסה 12 (6+6=12) ואילו לשני יש מספר מסה 14 (6+8=14). אטומים בעלי אותו מספר אטומי, בעלי תכונות כימיות זהות ונימצאים באותו מקום בטבלה המחזורית נקראים איזוטופים. כדי להבדיל בין האיזוטופים השונים של אטום מסויים מקובל לרשום את סמל האטום כשמשמאלו למעלה רשום מספר המסה ומשמאל למטה רשום מספר האטומי: לדוגמא ניתן לראות את הסימון השונה לפחמן בעל מסה 12 ופחמן בעל מסה 14: ![]() .
.
ראיות לקיום הגרעין
איזוטופים
כפי שאנו יודעים כל יסוד מאופיין ע"פ המספר האטומי שלו, כלומר מספר הפרוטונים בגרעין. המספר האטומי הוא המעניק את לאטום את הזהות של יסוד מסויים, ולפיו אנו מסוגלים להבדיל בין יסוד אחד למשנהו. לפיכך אטום בעל 6 פרוטונים ו- 6 ניוטרונים הוא אטום פחמן כפי שאטום בעל 6 פרוטונים ו-8 ניוטרונים הוא אטום פחמן. כיוון שהטבלה המחזורית מסודרת לפי מספר אטומי עולה נוכל בנקל לראות שאת שני אטומי הפחמן שהצגנו נמקם באותו מקום.
עולה השאלה אם כך מה ההבדל בין שני אטומי הפחמן שהוזכרו? ההבדל הבולט ביותר הוא במסה - לראשון יש מספר מסה 12 (6+6=12) ואילו לשני יש מספר מסה 14 (6+8=14). אטומים בעלי אותו מספר אטומי, בעלי תכונות כימיות זהות ונימצאים באותו מקום בטבלה המחזורית נקראים איזוטופים. כדי להבדיל בין האיזוטופים השונים של אטום מסויים מקובל לרשום את סמל האטום כשמשמאלו למעלה רשום מספר המסה ומשמאל למטה רשום מספר האטומי: לדוגמא ניתן לראות את הסימון השונה לפחמן בעל מסה 12 ופחמן בעל מסה 14: ![]() .
.
רדיואקטיביות
בטבלה המחזורית יש מספר של יסודות להם יש איזוטופים רדיואקטביים. משמעות הדבר שהם פולטים ממגרעינם חלקיקים ו/או אנרגיה באופן ספונטני. יש שלושה סוגים של קרינה רדיו אקטיבית:
- קרינת α (אלפא): קרינה בה נפלט גרעין של הליום מתוך גרעין האטום - כלומר נפלטים שני פרוטונים ושני ניוטרונים. לדוגמא
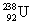 הופך אחרי פליטת קרינת α ל-
הופך אחרי פליטת קרינת α ל- 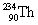 . הדבר מתבטא בירידה של 2 במספר האטומי וירידה של 4 במספר מסה.
. הדבר מתבטא בירידה של 2 במספר האטומי וירידה של 4 במספר מסה. - קרינת β (בטא): קרינה במהלכה נפלט אלקטרון 'מתוך הגרעין', המספר האטומי עולה באחד אך המסה נשארת. תיאוריה מקובלת המסבירה את פליטתו של אלקטרון מתוך הגרעין גורסת שניוטרון אחד מתפצל לאלקטרון שמשתחרר ולפרוטון שנשאר בגרעין. לדוגמא
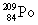 הופך לאחר שנפלטה ממנו קרינה β ל-
הופך לאחר שנפלטה ממנו קרינה β ל- 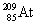 .
. - קרינת γ (גמא): קרינה המורכבת מאנרגיה בלבד -ללא חומר. אין היא משנה את תכונות האטום. האנרגיה הנפלטת היא בצורת גלים אלקטרומגנטים בעלי אורך הגל הקצר ביותר ולכן גם זוהי הקרינה האלקטרומגנטית החזקה ביותר.